1. Pengertian Polimer
Suatu molekul
raksasa (makromolekul) yang terbentuk dari susunan ulang molekul kecil yang
terikat melalui ikatan kimia disebut polimer (poly = banyak; mer = bagian). Suatu polimer akan terbentuk bila
seratus atau seribu unit molekul yang
kecil yang disebut monomer, saling
berikatan dalam suatu rantai.
Jenis-jenis monomer yang saling berikatan membentuk suatu polimer
terkadang sama atau berbeda. Sifat-sifat polimer berbeda dari monomer-monomer
yang menyusunnya. Pada contoh diatas,
teflon (politetra-fluoroetilena) yang berwujud padat dibuat bila
molekul-molekul gas tetra-fluoroetilena bereaksi membentuk rantai panjang.
Contoh lain, molekul-molekul gas etilena bereaksi membentuk rantai panjang
plastik polietilena yang ada pada kaleng susu[1].
Gambar 1. Perkembangan Bahan Polimer[2]
2. Struktur Polimer
Istilah polimer
digunakan untuk menggambarkan bentuk molekul raksasa atau rantai yang sangat
panjang yang terdiri atas unit-unit terkecil yang berulang-ulang atau mer atau
meros sebagai blok-blok penyusunnya. Molekul-molekul (tunggal) penyusun polimer
dikenal dengan istilah monomer. Polimer Polyethylene, misalnya, adalah salah
satu jenis bahan polimer dengan rantai linear sangat panjang yang tersusun atas
unit-unit terkecil (mer) yang berulang-ulang yang berasal dari monomer molekul
ethylene. Monomer memiliki ikatan kovalen tak jenuh (ikatan ganda) sedangkan
pada mer ikatan tersebut menjadi aktif atau ikatan kovalen terbuka dengan
elektron tak berpasangan[2].
Gambar 2. Struktur molekul polimer (polyethylene)[2]
3. Klasifikasi Polimer
Polimer umumnya diklasifikasikan menjadi
beberapa kelompok antara lain berdasarkan jenis monomer, asal, proses
pembentukannya, dan sifat termalnya.
3.1. Polimer Berdasarkan Jenis Monomernya
Berdasarkan jenis monomernya, polimer
dibedakan atas homopolimer dan kopolimer. Homopolimer terbentuk dari sejenis
monomer, sedangkan kopolimer terbentuk lebih dari sejenis monomer.
3.1.1.
Homopolimer
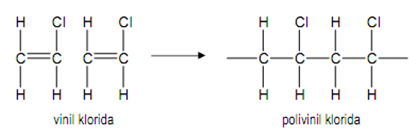
Homopolimer merupakan polimer yang terdiri dari satu macam monomer, dengan
struktur polimer. . . – A – A – A – A – A – A –. . . Salah satu contoh pembentukan homopolimer
dari polivinil klorida adalah sebagai berikut.
Gambar 3. Pembentukan homopolimer dari polivinil klorida[1]
3.1.2. Kopolimer
Kopolimer merupakan polimer yang
tersusun dari dua macam atau lebih monomer. Contoh: polimer SBS (polimer
stirena-butadiena-stirena).
Gambar 4. Polimer SBS (polimer stirena-butadiena-stirena)[1]
3.2. Polimer Berdasarkan
Asalnya
Berdasarkan asalnya, polimer dapat
dibedakan atas polimer alam dan polimer sintesis.
3.2.1. Polimer Alam
Polimer alam adalah polimer yang
terdapat di alam dan berasal dari makhluk hidup. Contoh polimer alam dapat
dilihat pada tabel di bawah ini.
Tabel 1. Contoh Polimer Alam[4]
No.
|
Polimer
|
Monomer
|
Polimerisasi
|
Contoh
|
1.
|
Pati/amilum
|
Glukosa
|
Kondensasi
|
Biji-bijian,
akar umbi
|
2.
|
Selulosa
|
Glukosa
|
Kondensasi
|
Sayur,
Kayu, Kapas
|
3.
|
Protein
|
Asam
amino
|
Kondensasi
|
Susu,
daging, telur, wol, sutera
|
4.
|
Asam
nukleat
|
Nukleotida
|
Kondensasi
|
Molekul
DNA dan RNA (sel)
|
5.
|
Karet
alam
|
Isoprena
|
Adisi
|
Getah
pohon karet
|
Sifat-sifat polimer alam kurang menguntungkan. Contohnya,
karet alam kadang-kadang cepat rusak, tidak elastis, dan berombak. Hal tersebut
dapat terjadi karena karet alamtidak tahan terhadap minyak bensin atau minyak
tanah serta lama terbuka di udara. Contoh lain, sutera dan wol merupakan
senyawa protein bahan makanan bakteri, sehingga wol dan sutera cepat rusak.
Umumnya polimer alam mempunyai sifat hidrofilik (suka air), sukar dilebur dan
sukar dicetak, sehingga sangat sukar mengembangkan fungsi polimer alam untuk
tujuan-tujuan yang lebih luas dalam kehidupan masyarakat sehari-hari.
3.2.2.
Polimer Sintesis
Polimer sintesis atau polimer buatan adalah polimer yang
tidak terdapat di alam dan harus dibuat oleh manusia. Sampai saat ini, para
ahli kimia polimer telah melakukan penelitian struktur molekul alam guna
mengembangkan polimer sintesisnya. Dari hasil penelitian tersebut dihasilkan
polimer sintesis yang dapat dirancang sifat-sifatnya, seperti tinggi rendahnya
titik lebur, kelenturan dan kekerasannya, serta ketahanannya terhadap zat
kimia. Tujuannya, agar diperoleh polimer sintesis yang penggunaannya sesuai
yang diharapkan. Polimer sintesis yang telah dikembangkan guna kepentingan
komersil, misalnya pembentukan serat untuk benang kain dan produksi ban yang elastis
terhadap jalan raya.. Contoh polimer sintesis dapat dilihat pada tabel di bawah
ini :
Tabel 2. Contoh
polimer sintesis[4]
No.
|
Polimer
|
Monomer
|
Terdapat
pada
|
1.
|
Polietena
|
Etena
|
Kantung,
kabel plastik
|
2.
|
Polipropena
|
Propena
|
Tali,
karung, botol plastik
|
3.
|
PVC
|
Vinil
klorida
|
Pipa
paralon, pelapis lantai
|
4.
|
Polivinil
alcohol
|
Vinil
alcohol
|
Bak
air
|
5.
|
Teflon
|
Tetrafluoroetena
|
Wajan
atau panci anti lengket
|
6.
|
Dakron
|
Metil
tereftalat dan etilena glikol
|
Pipa
rekam magnetik, kain atau tekstil (wol sintetis)
|
7.
|
Nilon
|
Asam
adipat dan heksametilena diamin
|
Tekstil
|
8.
|
Polibutadiena
|
Butadiena
|
Ban
motor
|
9.
|
Poliester
|
Ester
dan etilena glikol
|
Ban
mobil
|
10.
|
Melamin
|
Fenol
formaldehida
|
Piring
dan gelas melamin
|
11.
|
Epoksi
resin
|
Metoksi
benzena dan alcohol sekunder
|
Penyalut
cat (cat epoksi)
|
3.3
Polimer Berdasarkan Proses Pembentukannya
Reaksi
pembentukan polimer dinamakan polimerisasi, jadi reaksi polimerisasi adalah
reaksi penggabungan molekul-molekul kecil (monomer) membentuk molekul yang
besar (polimer). Ada dua jenis polimerisasi, yaitu polimerisasi adisi dan
polimerisasi kondensasi.
3.3.1. Polimer
adisi
Reaksi adisi adalah reaksi pemecahan ikatan rangkap
menjadi ikatan tunggal sehingga ada atom yang bertambah di dalam senyawa yang
terbentuk. Jadi, polimerisasi adisi adalah reaksi pembentukan polimer dari
monomer-monomer yang berikatan rangkap (ikatan tak jenuh). Pada reaksi ini
monomer membuka ikatan rangkapnya lalu berikatan dengan monomer lain sehingga
menghasilkan polimer yang berikatan tunggal (ikatan jenuh). Artinya, monomer
pembentuk polimer adisi adalah senyawa yang ikatan karbon berikatan rangkap seperti
alkena, sterina, dan haloalkena. Polimer adisi ini biasanya identik dengan
plastik, karena hampir semua plastik dibuat dengan polimerisasi adisi. Misalnya
polietena, polipropena, polivinil klorida, teflon dan poliisoprena.
Tabel 3. Contoh
Polimer Adisi[4]
No.
|
Nama
polimer
|
Kegunaan
|
1.
|
Polietilena
|
Tas
plastik, botol, mainan, isolasi listrik
|
2.
|
Polipropilena
|
Karpet
plastik, botol
|
3.
|
Polistirena
|
Pernis
kayu, styrofoam, isolasi plastik, gelas plastik, mainan, bahan pengepakkan
|
4.
|
Polivinil
klorida
|
Pipa,
genteng plastik
|
5.
|
Polivinil
dienklorida
|
Plastik
wrap
|
6.
|
Politetraetilena
(teflon)
|
Alat
masak, isolasi listrik (penutup kabel)
|
7.
|
Poliakrilonitril
|
Wig
(rambut palsu), cat, benang
|
8.
|
Polivinilasetat
|
Tekstil,
gumresin, cat
|
9.
|
Polimetilmetakrilat
|
Bahan
pembuat gelas, pembuat bola bowling
|
3.3.2.
Polimer Kondensasi
Kondensasi merupakan reaksi penggabungan gugus-gugus
fungsi antara kedua monomernya. Artinya, polimerisasi kondensasi adalah reaksi
pembentukan polimer dari monomer-monomer yang mempunyai dua gugus fungsi.
Misalnya, senyawa polipeptida atau protein dan polisakarida merupakan senyawa
biomolekul yang dibentuk oleh reaksi polimerisasi kondensasi. Berikut beberapa
contoh pembentukan polimerisasi kondensasi :
·
Pembentukan
nilon
Nilon merupakan
suatu polimer yang ditemukan oleh Wallace Hume Carothers di tahun 1934 sewaktu bekerja
di perusahaan Du Pont. Polimer nilon dibentuk dari monomer asam
6-aminoheksanoat (HOOCCH2(CH2)3CH2NH2).
Dalam polimerisasi ini, gugus karboksil dari monomer berikatan dengan gugus
amino dari monomer tersebut. Adapun nilon-66 dibentuk dengan heteropolimer
(monomernya beragam), yaitu antara heksametilena diamina, (1,6-heksana diamin)
dengan asam adipat (asam 1,6-heksanadioat). Pada heteropolimer (kopolimer)
setiap 2 monomer yang berlainan bersatu akan dihasilkan 2 molekul air.
·
Pembentukan
polyester (polietilena tereftalat) atau dakron
Sama halnya pada nilon-66, polyester dakron dibentuk oleh
2 polimer berlainan, yaitu dari etilena glikol (polialkohol) dengan dimetil
tereftalat (senyawa ester). Polimerisasi kondensasi akan menghasilkan molekul
kecil air dan monomernya mempunyai gugus fungsi pada kedua ujung rantainya[4].
3.4. Polimer
Berdasarkan Sifat Termal
Berdasarkan sifat
termalnya, polimer dibagi menjadi 2 yaitu termoplastik dan termoset. Diagram
pembagian jenis-jenis polimer adalah pada Gambar 2.10.
Gambar 5. Kalsifikasi Polimer berdasarkan sifat termal[2]
3.4.1. Termoplastik
Termoplastik,
yaitu polimer yang bisa mencair dan melunak. Hal ini disebabkan karena polimer
- polimer tersebut tidak berikatan silang (linier atau bercabang) biasanya bisa
larut dalam beberapa pelarut. Bahan-bahan yang bersifat termoplastik mudah
untuk diolah kembali karena setiap kali dipanaskan, bahan-bahan tersebut dapat
dituangkan ke dalam cetakan yang berbeda untuk membuat produk plastik yang
baru. Polietilen (PE) dan polivinilklorida (PVC) merupakan contoh jenis polimer
ini[1].
Gambar 6. Bentuk struktur
termoplastik[7]
Gambar 7. Bentuk struktur
bercabang termoplastik[7]
Polimer
termoplastik memiliki sifat – sifat khusus sebagai berikut.
·
Berat molekul kecil
·
Tidak tahan terhadap panas.
·
Jika dipanaskan akan melunak.
·
Jika didinginkan akan mengeras.
·
Mudah untuk diregangkan.
·
Fleksibel.
·
Titik leleh rendah.
·
Dapat dibentuk ulang (daur ulang).
·
Mudah larut dalam pelarut yang sesuai.
·
Memiliki struktur molekul linear/bercabang[7].
Tabel 4. Contoh Polimer
Termoplastik[7]
No.
|
Contoh Polimer Termoplastik
|
Aplikasi
|
1.
|
Polietilena (PE)
|
Botol plastik,
mainan, bahan cetakan, ember, drum, pipa saluran, isolasi kawat dan kabel,
kantong plastik dan jas hujan
|
2.
|
Polivinilklorida (PVC)
|
Pipa air, pipa
plastik, pipa kabel listrik, kulit sintetis, ubin plastik, piringan hitam,
bungkus makanan, sol sepatu, sarung tangan dan botol detergen
|
3.
|
Polipropena (PP)
|
karung, tali,
botol minuman, serat, bak air, insulator, kursi plastik, alat-alat rumah
sakit, komponen mesin cuci, pembungkus tekstil, dan permadani
|
4.
|
Polistirena
|
Insulator, sol
sepatu, penggaris, gantungan baju
|
3.4.2. Termoset
Polimer termoseting adalah polimer yang mempunyai sifat tahan
terhadap panas. Jika polimer ini dipanaskan, maka tidak dapat meleleh. Sehingga
tidak dapat dibentuk ulang kembali. Susunan polimer ini bersifat permanen pada
bentuk cetak pertama kali (pada saat pembuatan). Bila polimer ini rusak/pecah,
maka tidak dapat disambung atau diperbaiki lagi.
Polimer
termoseting memiliki ikatan – ikatan silang yang mudah dibentuk pada waktu
dipanaskan. Hal ini membuat polimer menjadi kaku dan keras. Semakin banyak
ikatan silang pada polimer ini, maka semakin kaku dan mudah patah. Bila polimer
ini dipanaskan untuk kedua kalinya, maka akan menyebabkan rusak atau lepasnya
ikatan silang antar rantai polimer[7].
Gambar 8. Bentuk struktur
ikatan silang sebagai berikut[7]
Sifat polimer
termoseting sebagai berikut.
·
Keras dan kaku (tidak fleksibel)
·
Jika dipanaskan akan mengeras.
·
Tidak dapat dibentuk ulang (sukar didaur
ulang).
·
Tidak dapat larut dalam pelarut apapun.
·
Jika dipanaskan akan meleleh.
·
Tahan terhadap asam basa.
·
Mempunyai ikatan silang antarrantai molekul[7].
Tabel 5. Contoh Polimer Termoset[5]
No.
|
Tipe
|
Singkatan
|
Kegunaan
|
1.
|
Fenol-formaldehida
|
PF
|
Alat listrik
dan elektronik, bagian mobil, perekat plywood,
utensil handle
|
2.
|
Urea-formaldehida
|
UF
|
Alat listrik
dan elektronik, bagian mobil, perekat plywood,
utensil handle, dan bahan pelapis
|
3.
|
Poliester tak jenuh
|
-
|
Konstruksi,
bagian - bagian mobil, lambung kapal,aksesoris kapal, saluran anti korosi,
pipa, tangki dan lain-lain, peralatan bisnis
|
4.
|
Epoksi
|
-
|
Bahan pelapis
protektif, perekat, aplikasi-aplikasi listrik dan elektronik, bahan lantai
industri, bahan pengaspal jalan raya, bahan paduan (komposit)
|
5.
|
Melamin-formaldehida
|
MF
|
Alat listrik
dan elektronik, bagian mobil, perekat plywood,
utensil handle, bahan pelapis, bingkai dekoratif, tutup meja, perkakas
makanan.
|
4. Pembentukan Polimer
Proses
pembentukan rantai molekul raksasa polimer dari unit-unit molekul terkecilnya
(mer atau meros) melibatkan reaksi yang kompleks. Proses polimerisasi tersebut
yang secara umum dapat dikelompokkan menjadi dua jenis reaksi, yaitu
polimerisasi adisi (Addition), dan
polimerisasi kondensasi (Condensation)[6].
Gambar 9. Jenis Reaksi Pembentukan Polimer[6]
4.1. Reaksi Adisi
Reaksi adisi
seperti yang terjadi pada proses pembentukan makro molekul polyethylene dari
molekul-molekul ethylene, berlangsung secara cepat tanpa produk samping (by-product) sehingga sering disebut pula
sebagai Pertumbuhan Rantai (Chain Growth). Contoh polimerisasi
dengan reaksi adisi adalah proses pembentukan Polyethylene (PE).
Proses
pembentukan polimer berlangsung dalam 3 tahap, yaitu :
(1) inisiasi,
(2) adisi atau
pertumbuhan rantai, dan
(3) terminasi.
Untuk memulai
proses polimerisasi ethylene, ditambahkan H2O2 sehingga terjadi pemutusan
ikatan kovalen antar oksigen dalam molekul Hidrogen Peroksida dan ikatan
kovalen antar karbon dalam molekul Ethylene. Polimerisasi dimulai dengan
terbentuknya dua kelompok inisiator (OH) dan mer. Satu dari dua kelompok OH selanjutnya akan
bergabung dengan mer ethylene mengawali terbentuknya rantai molekul polimer.
Selanjutnya akan terjadi pertumbuhan rantai yang berlangsung sangat cepat
membentuk rantai molekul raksasa linear. Terminasi dari
pertumbuhan rantai dapat dilakukan dengan dua cara, yaitu :
(1) dengan
bergabungnya OH ke ujung rantai molekul, dan
(2) bergabungnya
dua rantai molekul.
Panjang dari rantai polimer dapat dikendalikan
dengan cara mengendalikan jumlah inisiator.
Secara, umum, jika jumlah inisiator yang diberikan sedikit, maka jumlah
OH yang tersedia untuk menghentikan reaksi semakin sedikit pula. Perlu dicatat bahwa
di reaksi adisi ini tidak menghasilkan produk sampingan[6]. Adapun sebagai
contoh proses adisi adalah polyethylene dan reaksi pembentukannya digambarkan
pada gambar 10 di bawah ini.
Gambar 10. Proses Pembentukan Polyethylene[6]
4.2. Reaksi Kondensasi
Polimerisasi kondensasi, seperti yang misalnya
pada pembentukan bakelit dari dua buah mer berbeda, berlangsung tahap demi
tahap (Step Growth) dengan
menghasilkan produk samping, misalnya molekul air yang dikondensasikan keluar.
Contoh dari polimerasi kondensasi adalah
proses pembentukan Bakelit yang telah kita kenal sebelumnya. Nama kondensasi
diberikan karena pada proses polimerisasi ini dikondensasikan molekul air
sebagai produk sampingan (by product)-nya. Bakelit, produk utama dari reaksi ini,
terbentuk dari dua jenis molekul mer, yaitu Phenol dan Formal Dehide. Tidak seperti halnya pada polimerisasi adisi,
reaksi berlangsung lebih lambat, tahap demi tahap, sehingga sering pula
disebutsebagai reaksi pertumbuhan tahap demi tahap (step growth reaction). Rantai molekul yang terbentuk dalam proses
polimerisasi bakelit ini lebih rigid, karena membentuk jejaring tiga
dimensi (three dimensional network) yang kompleks[6]. Untuk proses
kondensasi contohnya adalah polyethylene dan reaksi pembentukannya digambarkan
pada gambar 11.
Gambar 11. Proses
Pembentukan Bakelite[6]
REFERENSI
[1] Dra. Utiya Azizah, M.Pd. 2004. Polimer. Bagian
Proyek Pengembangan Kurikulum Direktorat Pendidikan Menengah Kejuruan
Direktorat Jenderal Pendidikan Dasar Dan Menengah Departemen Pendidikan
Nasional 2004.
[2] Rahmat Saptono. 2008. Pengetahuan
Bahan-Polimer. Departemen Metalurgi dan Material FTUI.
[3] Malcolm, P.S., 2001. Polymer Chemistry
: An Introduction, diindonesiakan oleh Lis Sopyan, cetakan pertama, PT
Pradnya Paramita : Jakarta.
[4] Anonim. 2008. Pengelompokkan dan Kegunaan
Polimer.
[5] Anonim. 2008. Ilmu Material : Kimia Polimer.
[6] Odian, G. 1991. Principles of
Polymerization. 3rd edition, John Wiley & Sons, Inc : New
York.
[7] http://www.chem-is-try.org/materi_kimia/kimiapolimer/klasifikasi-polimer/polimer termoplastik-dan-termosetting/ diakses pada tanggal 8
Desember 2010 pada pukul 09.24 WIB